اسید و باز لوئیس
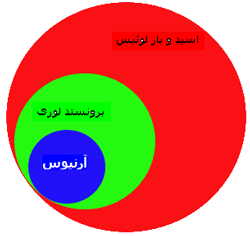
تاریخچه: نظریهی اسید و باز لوئیس، روش جامع تری برای توصیف واکنش های بین H+ و OH- است. نظریهی اسید و باز برونستد– لوری به طور مقدماتی روی اسیدها و بازهایی که به عنوان دهندهها و پذیرندههای پروتون عمل میکنند، بحث میکند.
این نظریه میگوید: اسیدها موادیاند که در محلول، یونهای هیدروژن تولید میکنند و بازها موادیاند که یونهای هیدروکسید در محلول تولید میکنند و خنثی شدن اسید و باز زمانی اتفاق میافتد که این یونها با هم واکنش میدهند تا آب تولید کنند:

در سال ١٩٢٣ جی. ان. لوئیس نظریهای در تکمیل مفهوم اسیدها و بازها ارائه داد که توصیفی بسیار کلی از اسیدها و بازها بر روی ساختار و پیوند مواد میدهد.
نظریهی لوئیس به جای استفاده از انتقال پروتون، از انتقال الکترونها استفاده میکند و بیان میکند که اسید لوئیس ماده ای است که یک جفت الکترون میپذیرد (مشهور به الکتروندوست) و اوربیتال خالی خواهد داشت:
مانند: BF٣، H+، Cu٢+، Cr٣+
باز لوئیس مادهای است که جفت الکترون خود را در واکنش از دست میدهد (مشهور به هسته دوست) و جفت الکترون تنها خواهد داشت:
مانند: NH٣، OH-، H٢O
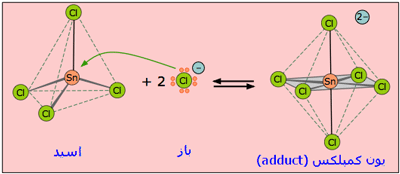
واکنش اسید و باز لوئیس، پیوند کوئوردینانس کوالانسی تولید خواهد کرد؛ شکل زیر این مطلب را به خوبی نشان میدهد:

در واکنش یون هیدروکسید با یون هیدروژن، یون هیدروکسید یک جفت الکترون برای تشکیل پیوند کوالانسی میدهد، بنابراین در این واکنش، OH- باز لوئیس است. یون هیدروژن، یک جفت الکترون میپذیرد، بنابراین به عنوان اسید لوئیس عمل میکند:
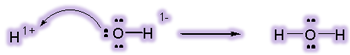
حال با مثالی دیگر از واکنش اسید و باز لوئیس توضیح خواهیم داد که هر واکنشی نمیتواند به صورت واکنش اسید و باز برونستد- لوری باشد:
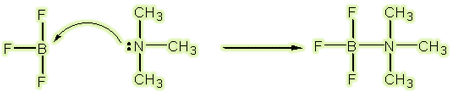
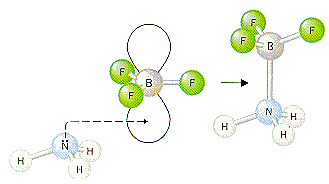
BF٣ اسید لوئیس و N(CH٣(٣ باز لوئیس است. هر دو الکترون در پیوند کوالانسی که توسط واکنش اسید و باز لوئیس تشکیل میشود، از همان اتم نیتروژن که دو الکترون خود را میدهد، تأمین میشود.
چنین پیوندهایی همان گونه که در بالا ذکر شد، پیوندهای کوئوردینانس کوالانسی نامیده میشوند. برای تأکید بر روی کوئوردینانسی بودن چنین پیوندی، اغلب از یک فلش به جای خط پیوند در ساختار لوئیس مواد استفاده میشود. جهت این فلش از اتم دهنده به سمت اتم پذیرنده است:
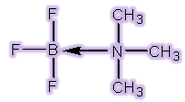
چنین محصولی که از واکنش اسید و باز لوئیس تولید می شود، ترکیب افزایشی یا به طور رایج تر، محصول افزایشی (adduct) یایون کمپلکس نامیده می شود.
 چه موادی اسید لوئیس هستند؟
چه موادی اسید لوئیس هستند؟ اسیدهای لوئیس، به دلیل آنکه جفت الکترون میگیرند، الکتروندوست هستند؛ یعنی الکترونها را جذب میکنند.
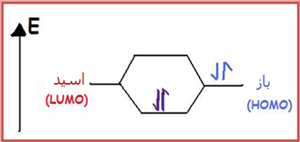
یک اسید در هنگام پیوند با یک باز از پایینترین اوربیتال مولکولی اشغالنشدهی خود (LUMO) استفاده میکند (شکل زیر).
** مواد مختلفی از جمله تمام کاتیونها اسید لوئیس هستند؛ زیرا قادر به پذیرفتن الکترونها هستند، مانند:
Cu٢+, Fe٢+, Fe٣+
** یک اتم، یون یا مولکول با آرایش الکترونی ناکامل هشتتایی (لایهی ظرفیت آنها به هشت الکترون نمیرسد) میتواند به عنوان اسید لوئیس رفتار کند، مانند:
BF٣, AlF٣
** مولکولهایی که اتم مرکزی آنها میتواند بیشتر از هشت الکترون لایهی ظرفیت داشته باشد، میتوانند پذیرندههای الکترون باشند و در طبقه بندی اسیدهای لوئیس قرار گیرند، مانند:
SiBr٤, SiF٤
** مولکولهایی که چندین پیوند بین دو اتم با الکترونگاتیوی متفاوت دارند، اسید لوئیس به شمار میروند، مانند:
CO٢, SO٢

چه موادی باز لوئیس هستند؟
بازهای لوئیس به دلیل آن که جفت الکترون های خود را می بخشند، هسته دوست نامیده می شوند؛ یعنی با جفت الکترون تنهای خود، بار مثبت را مورد هدف قرار می دهند. بازهای لوئیس بالاترین اوربیتال مولکولی اشغال شده (HOMO) را مورد استفاده قرار می دهند (شکل بالا).
** یک اتم، یون یا مولکول با یک جفت الکترون تنها میتواند باز لوئیس باشد. هر کدام از آنیون های زیر می توانند الکترون های خودشان را به یک اسید واگذار کنند:
OH-, CN-, CH٣COO-, :NH٣, H٢O:, CO:
HOMO و LUMO:
اسید و باز لوئیس؛ هر دو دارای اوربیتال های اشغال شده و خالی هستند؛ اما بالاترین اوربیتال مولکولی اشغال شده ی (HOMO) باز لوئیس با پایین ترین اوربیتال مولکولی اشغال نشده ی (LUMO) اسید لوئیس واکنش می دهد تا اوربیتال های مولکولی متصل به هم را تشکیل دهند.
اسیدهای لوئیس به دلیل آن که اوربیتال های خالی دارند، در تراز انرژی پایین تری هستند؛ ولی بازهای لوئیس به دلیل این که جفت الکترون تنها دارند، تراز انرژی بالاتری را اشغال می کنند.
ایرادات نظریهی اسید و باز لوئیس:
با اینکه این نظریه ایرادات نظریههای اسید و باز آرنیوس و برونستد- لوری را ندارد و واکنش اسیدها و بازها را به خوبی توجیه می کند، اما ایراداتی نیز دارد:
· این نظریه برای قدرت نسبی اسیدها و بازها نمی تواند دلیل موجهی بیاورد چون بر اساس یونش نیست.
· یک واکنش اسید و باز، واکنش انتقال الکترون است و باید کاملاً سریع باشد اما بسیاری از واکنش های اسید و باز به صورت کند روی می دهند.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

