آنتالپی های استاندارد
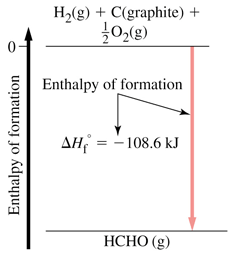
آنتالپی استاندارد تشکیل
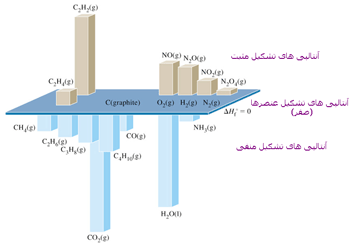
مقدار گرمای واکنشی که طی آن یک مول ماده از عناصر سازنده اش تشکیل می شود، آنتالپی استاندارد تشکیل آن ماده می گویند. آنتالپی استاندارد تشکیل عنصرها صفر در نظر گرفته می شود.
C(s, graphite) + 2 H2(gas) ---> CH4(gas) ; DHfo = qp = DHrxno
حالت استاندارد کربن، گرافیت است که صفر در نظر گرفته می شود. تشکیل الماس از گرافیت به اندازه 9/1 کیلوژول بر مول گرما گیر است. (حالت استاندارد هر ماده حالتی است که ماده بیشتر به آن صورت در طبیعت باشد).
|
|
آنتالپی استاندارد مواد اکثراً منفی است. زیرا تشکیل مواد گرماده است.
آنتالپی استاندارد سوختن
هنگامی که یک مول از ماده ای در مقدار کافی گاز اکسیژن خالص بسوزد، مقداری گرما آزاد می کند، به این مقدار گرما،آنتالپی استاندارد سوختن می گویند. معمولاً این کار در بمب کالری متری انجام می گیرد.
که آن را با 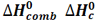 نشان می دهند.
نشان می دهند.
در زیر آنتالپی استاندارد سوختن چند ماده را می بینید.
C(graph) + 02(g) ---> CO2(g) H o c = - 394 kJmol-1
C2H6 + 3.5O2 --> 2CO2 + 3H2O H o c= -1560 kJ mol-1
C2H4 + 3O2 --> 2 CO2 +2 H2O H o c= -1409 kJ mol-1
C2H2 + 5/2 O2 --> 2 CO2 + H2O H o c= -1409 kJ mol-1
شعله استیلن داغ تر از اتیلن و شعله اتیلن داغ تر از اتان است. زیرا تعداد ملکول تشکیل شده در استیلن کمتر از اتیلن و اتیلن کمتر از اتان است.
آنتالپی استاندارد تبخیر
تغییر آنتالپی مربوط به تبخیر یک مول از ماده ای در نقطه جوش خود، آنتالپی تبخیر نامیده می شود که آن را با 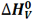 نمایش می دهیم.
نمایش می دهیم.
برای تبخیر یک مول آب 1/41 کیلوژول گرما نیاز است.
H2O(l) + 41.1 KJ ---> H2O(g) H o v [H2O(l)] = 41.1 KJ/mol
آنتالپی استاندارد ذوب
تغییر آنتالپی مربوط به ذوب یک مول از ماده ای در نقطه ذوب خود، آنتالپی استاندارد ذوب نامیده می شود که آن را با 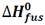 نمایش می دهیم.
نمایش می دهیم.
H2O(s) + 6.0 KJ ---> H2O(l) Hfus0[H2O(l)] = 6.0 KJ/mol
که همان گرمای نهان ذوب است.
در هنگام ذوب شدن یک ماده، تنها باید بتوان كمی پیوندهای بین گونه ها (اتم، مولكول یا یون) را سست كرد تا گونه ها بتوانند در حالت مایع، آزادی بیشتری داشته باشند.
اما در هنگام تبخیر، باید گونه ها بتوانند خود را به طور كامل از پیوندهای موجود برهانند و از محلول خارج شده به سمت بالا بروند. از این رو دو انرژی یكی برای غلبه كامل بر پیوندهای موجود و گسستن كامل آن ها و دوم انرزی برای غلبه بر شتاب گرانش و رفتن به سمت بالا نیاز دارند. به همین دلیل همواره گرما و انرژی بیشتری برای تبخیر مورد نیاز است یا به بیانی دیگر آنتالپی تبخیر برای یک ماده خاص همواره بیشتر از آنتالپی ذوب می باشد.
آنتالپی استاندارد تصعید
به تغییر آنتالپی واکنش مربوط به تصعید یک مول از ماده، آنتالپی استاندارد تصعید می گویند و آن را با 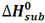 نمایش می دهند.
نمایش می دهند.
NH4Cl ---> HCl + NH3
CO2(s) ----> CO2(g) Hsub0 = 25 KJ/mol
شکل زیر یخ خشک را نشان می دهد که درحال تصعید (فرازش) است. عکس عمل تصعید، چگالش نامیده می شود.

متوسط آنتالپی پیوند
برای شکستن پیوند کووالانسی باید انرژی صرف شود و هنگام تشکیل پیوند، انرژی آزاد می شود. ارقام بسیاری از انرژی های پیوندی، متوسط هستند. زیرا مقدار انرژی لازم برای شکستن آن پیوند در یک ملکول متفاوت است. مثلاً برای شکستن پیوند های C-H در CH4 انرژی لازم برای شکستن اولین پیوند C-H با دومی و با سومس و سومی با چهارمی متفاوت است. برای مثال پیوند O-H در ملکول H-O-H دارای انرژی تفکیک 4/493 کیلوژول بر مول است درحالی که برای شکستن پیوند O-H دوم خود نیازمند 4/424 کیلو ژول بر مول انرژی است که مقدار متوسط آن 9/458 کیلو ژول بر مول می باشد.
برای متان مقادیر انرژی تفکیک پیوند های C-H به ترتیب برابر:
435، 444، 444، 339 کیلوژول بر مول انرژی برای جدا کردن اولین، دومین، سومین و چهارمین پیوند لازم است که متوسط آن 415 کیلوژول بر مول است.
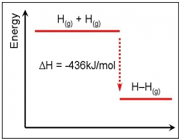
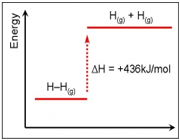
تشکیل H2
تفکیک H2
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:







 آمار
وب سایت:
آمار
وب سایت:

