قانون بویل
رابرت بویل این قانون را در سال 1662، با دادن رابطه ای بین فشار و حجم جرمی معین از یک گاز در دمای ثابت، پیشنهاد کرد.
این قانون بیان می کند که در دمای ثابت حجم جرمی معین از گاز با فشار آن گاز به طور عکس متناسب است که به صورت زیر بر قرار است :
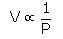
در شرایطی که دما ثابت است و یا PV = K = ثابت. زمانی که در یک دمای معین فشار گاز از P1 به P2 تغییر کند، رابطه می نتیجه شود:
P1V1 = P2 V2 = ثابت
در جایی که V2 حجم نهایی گاز محسوب می شود. حاصل ضرب حجم و فشار یک جرم معین از گاز در دمای ثابت، یک مقدار ثابتی می شود. از نظر آزمایشگاهی می توان این مسئله را با تهیه کردن نمودار فشار - حجم برای 10g از گاز اکسیژن در دمای 25 درجه سانتی گراد تأیید کرد. در نهایت مشاهده خواهد شد که با افزایش فشار، حجم کاهش می یابد و حاصل ضرب PV به صورت ثابت برقرار می گردد.
شکل 1 - تغییر فشار و حجم در دمای ثابت
منحنی نشان می دهد که ارتباط بین فشار و حجم به طور عکس می باشد. زمانی که فشار، P1 است، حجم V1 و زمانی که فشار به P2 افزایش می یابد، حجم V2 کمتر از حجم V1 می شود. اگر بخواهیم نمودار را به صورت فشار بر حسب عکس حجم رسم کنیم به شکل خطی راست که از مبدأ عبور می کند، به دست می آید:
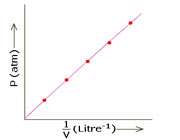
شکل 2 - نمودار فشار در مقابل عکس حجم
و در حالی که نمودار را به صورت حاصل ضرب PV (در طول محور y ) بر حسب فشار (در طول محور x ) رسم کنیم، به شکل خطی افقی به دست می آید که PV نشان دهنده ی یک مقدار ثابت می باشد حتی در شرایطی که ما فشار را تغییر دهیم.
منحنی فشار - حجم در دماهای مختلف برای یک گاز معین، متفاوت است. نمودار PV در مقابل P در دمای متفاوت به عنوان نمودار هم دما شناخته می شود به طوریکه منحنی بالاتر مربوط به دمای بالاتری می شود. قانون بویل در واقع طبیعت تراکم پذیر گاز را که اندازه ای از دانسیته ی افزایش یافته اش می باشد، بیان می کند.
مسئله :
گازی با حجم 250ml در فشار 745 میلی متر جیوه و در دمای 25 درجه سانتی گراد می باشد. برای این که حجم گاز به200ml کاهش یابد، به چه افزایش فشاری در همان غلظت نیاز است ؟
راه حل :

بنابراین افزایش فشار، به صورت زیر می شود:
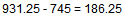
در نتیجه افزایش فشار 25/186 میلی متر جیوه می شود.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:









 آمار
وب سایت:
آمار
وب سایت:

